Vidal
La Commission européenne, relayée par l’ANSM le 12 juin 2018, vient d‘entériner et de renforcer les dispositions françaises relatives à l’utilisation du valproate et de ses dérivés,médicaments à haut risque tératogène.
A partir du 30 juin 2018, ces médicaments seront en effet interdits chez les patientes atteintes d’épilepsie ou de maladie bipolaire enceintes ou en âge de procréer, sauf exception (chez une patiente qui n’est pas enceinte, si le valproate est la seule alternative thérapeutique possible et lePlan de prévention de la grossesse scrupuleusement respecté).
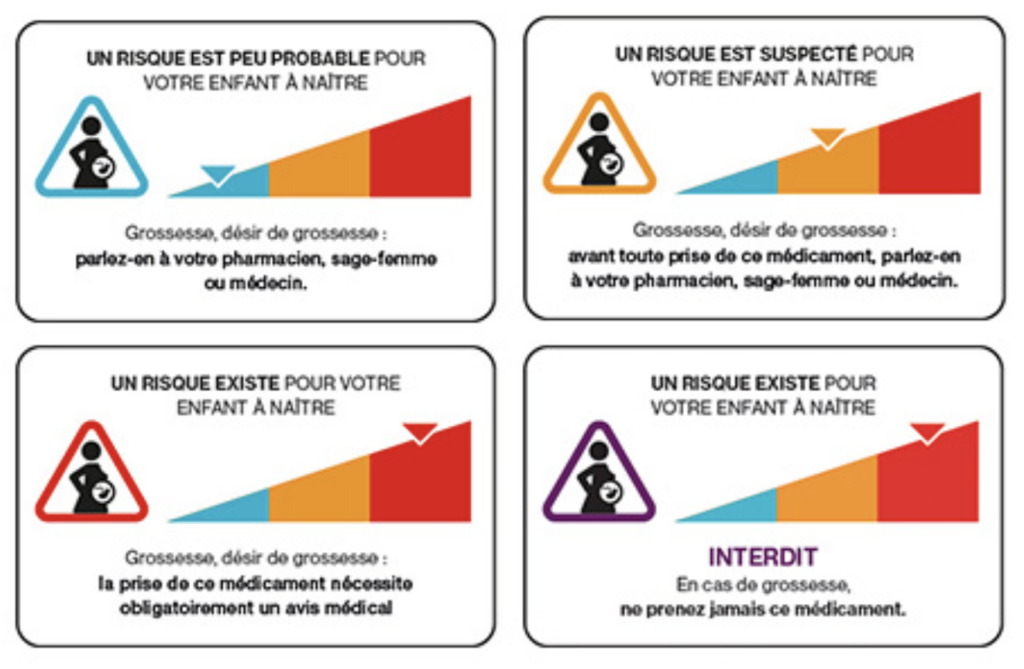
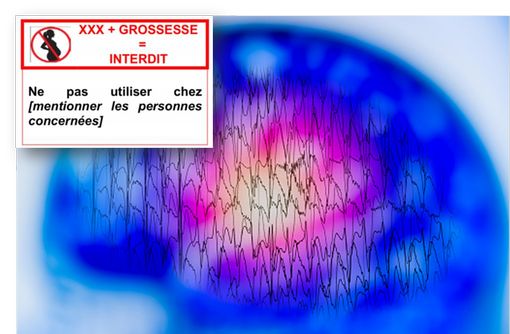
Le conditionnement de ces spécialités (DEPAKINE, DEPAKINE CHRONO, DEPAMIDE, MICROPAKINE LP et DEPAKOTE, et les génériques), ainsi que leurs blisters, sachets et flacons porteront désormais le pictogramme grossesse avec la mention « VALPROATE + GROSSESSE = INTERDIT » au lieu de « VALPROATE + GROSSESSE = DANGER ».
Enfin, la carte patiente, actuellement remise par le médecin ou le pharmacien, sera intégrée aux boîtes de médicament.
Le valproate (DEPAKINE et dérivés) contre-indiqué chez toutes les adolescentes et femmes en âge de procréer
La Commission européenne a décidé d’étendre à l’Europe et de renforcer les mesuresprises par la France depuis 2015 pour endiguer les risques tératogènes liés à l’utilisation des spécialités de valproate et dérivés.
L’utilisation de ces spécialités sera donc interdite, à partir du 30 juin 2018, chez toutes les patientes enceintes et en âge de procréer, quelle que soit l’indication :
-
en neurologie : traitement de l’épilepsie (DEPAKINE, DEPAKINE CHRONO et MICROPAKINE) et traitement de la migraine (aucune spécialité de valproate ne dispose de cette indication en France) ;
- en psychiatrie : traitement des épisodes maniaques ou des troubles bipolaires (DEPAKOTE, DEPAMIDE).
Utilisé dans le traitement de l’épilepsie et en psychiatrie, le valproate est un tératogène puissant. Sa prise est associée à un taux élevé de malformations (plus de 10 %) et/ou de troubles neuro-développementaux (30 – 40 %) chez les enfants exposés pendant la grossesse.
Malgré la mise en place de mesures restrictives depuis 2015, l’utilisation du valproate chez les femmes en âge de procréer reste observée, avec un risque d’exposition foetale encore important (voir notre article du 25 octobre 2017).
Exception à cette interdiction : pas d’autre option thérapeutique et respect des conditions du Plan de prévention de la grossesse
Chez toutes les patientes en âge de procréer, le valproate ne doit donc plus être prescrit, « sauf en cas d’inefficacité ou d’intolérance aux alternatives« , précise l’ANSM dans son communiqué du 12 juin 2018.
Autrement dit, un traitement par valproate ne doit être envisagé qu’en dernière intention, en cas d’échec des alternatives thérapeutiques, y compris chez les filles et les adolescentes.
Si le valproate est la seule option, tout doit être mis en oeuvre pour éviter une grossesse, selon le Plan de prévention grossesse. Ce plan comprend :
- une information complète de la patiente sur les risques tératogènes,
- une réévaluation annuelle de l’intérêt du traitement,
- des tests de grossesse,
- la prise d’au moins une contraception efficace,
- la signature annuelle de l’accord de soins.
La mention « VALPROATE + GROSSESSE = INTERDIT » étendue aux spécialités de valproate contre l’épilepsie
En France, pour les spécialités de valproate indiquées en psychiatrie, l’interdiction du valproate au cours de la grossesse et la contre-indication chez les femmes en âge de procréer est appliquée en France depuis juillet 2017 (voir notre article du 6 juillet 2017) . Depuis cette date, les spécialités DEPAKOTE et DEPAMIDE portent donc un pictogramme(silhouette de femme enceinte dans un rond rouge barré) avec la mention suivante : « VALPROATE + GROSSESSE = INTERDIT. Ne pas utiliser chez les femmes en âge de procréer et sans contraception efficace, ou enceintes ».
Suite à la décision de la Comission européenne, cette mise en garde est désormais étendue aux spécialités indiquées dans l’épilepsie. Les conditionnements de ces spécialités, ainsi que les blisters, sachets et flacons, porteront, en sus du pictogramme, la mention « VALPROATE + GROSSESSE = INTERDIT » en remplacement de « VALPROATE + GROSSESSE = DANGER » (mention actuellement inscrite sur les conditionnements de ces spécialités).
NDLR : il s’agit donc d’une situation totalement différente de celle des traitements de l’asthme, pour lesquels l’Académie de Médecine et la SPLF jugent que l’apposition de pictogrammes sur les boites d’antiasthmatiques est dangereuse (voir notre article du 7 juin 2018).
Carte-patiente : directement dans les boîtes
Les autorités européennes ont également décidé d’intégrer dans les boîtes la carte patiente, actuellement remise par le médecin ou le pharmacien.
Ne pas arrêter un traitement sans avis médical
Dans ce contexte, les autorités de santé françaises et européennes rappellent aux patientes de ne pas arrêter ou modifier seules leur traitement anti-épileptique ou psychiatrique sans avis médical.
Les femmes qui désirent avoir un enfant doivent être invitées à consulter leur médecin afin d’envisager le recours à des alternatives au valproate.
Mise à jour imminente des documents et recommandations
Les autorisations de mise sur le marché (AMM) des médicaments contenant du valproate vont être modifiées en France avant la fin du mois de juin 2018 pour intégrer ces mesures.
La brochure pour les patientes, le guide d’information pour les médecins et le formulaire d’accord de soins vont être actualisés et seront disponibles fin juillet 2018.
Un « QR » code sera également mis en place sur ces boites et renverra à un site Internet qui délivrera une information validée dédiée aux risques liés à l’exposition au valproate au cours de la grossesse.
En complément, la Haute autorité de santé (HAS) travaille en collaboration avec l’ANSM et l’APESAC pour actualiser les recommandations thérapeutiques sur les alternatives au valproate chez les filles, adolescentes, femmes en âge de procréer et femmes enceintes.
Pour aller plus loin
Le valproate est interdit pendant la grossesse et ne doit plus être prescrit aux filles, adolescentes et femmes en âge de procréer (sauf circonstances exceptionnelles) – Communiqué (ANSM, 12 juin 2018)
Nouvelles mesures pour limiter l’exposition au valproate pendant la grossesse – en anglais (EMA, 31 mai 2018)
Sur VIDAL.fr
Valproate et dérivés : des conditions de prescription et de délivrance insuffisamment respectées en 2017 (25 octobre 2017)
DEPAKOTE et DEPAMIDE : contre-indiqués chez les femmes enceintes ou en âge de procréer sans contraception efficace (6 juillet 2017)
Valproate et grossesse : un risque de malformations congénitales majeures 2 à 4 fois supérieur (24 avril 2017)
Epilepsie et grossesse : pictogramme d’alerte sur les boîtes de valproate et dérivés (6 mars 2017)
Valproate de sodium et risque tératogène : quelles sont les alternatives thérapeutiques ? (10 décembre 2015)
Médicaments à base de valproate et dérivés : renforcement des conditions de prescription et de délivrance (27 mai 2015)
Source = Vidal