Europe 1
Nouveau durcissement en 2025 pour la prescription et la délivrance d’anti-épileptiques en France : l’agence du médicament (ANSM) a annoncé vendredi des modifications pour l’octroi de plusieurs traitements.
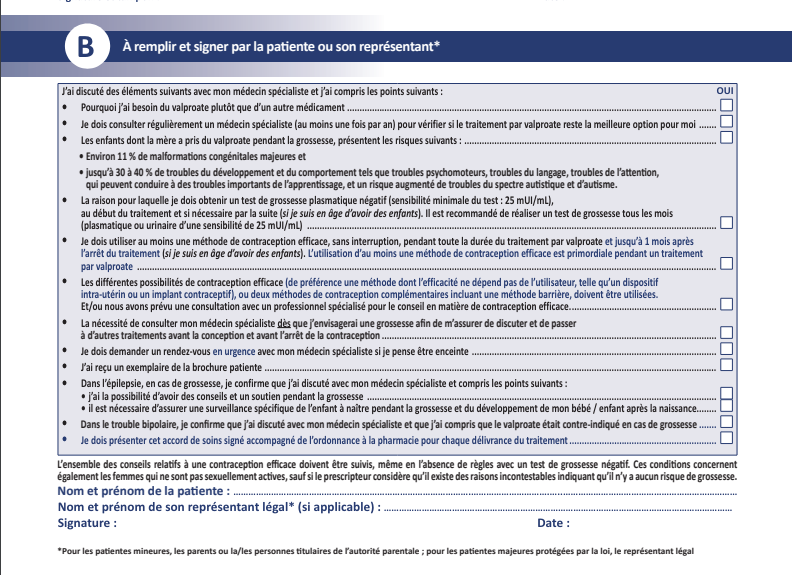
Face aux risques pour le fœtus, la France va durcir une nouvelle fois, en 2025, la prescription et la délivrance d’anti-épileptiques, notamment du valproate pour de futurs pères, et renforcer l’information sur ces traitements à limiter aux situations incontournables. Plusieurs modifications sont en vue pour les médicaments à base de valproate et dérivés (Dépakine, Micropakine, Dépakote, Dépamide, Divalcote et génériques), carbamazépine (Tegretol et génériques) et Topiramate (Epitomax et génériques), à partir du 6 janvier, a annoncé vendredi l’agence du médicament (ANSM).
Avec ces changements « complémentaires à de précédentes actions », « l’objectif est de limiter l’exposition des enfants à naître à ces médicaments compte tenu de leurs risques », a résumé à l’AFP le directeur médical de l’agence du médicament (ANSM), le Dr Philippe Vella. Ces traitements sont indiqués dans l’épilepsie, mais parfois prescrits également contre certains troubles de l’humeur et psychiatriques, certaines migraines, certaines douleurs neuropathiques.
Risque « modéré » de troubles du développement chez les enfants
Pour les médicaments à base de valproate, aux dangers bien connus pour les femmes enceintes, le changement majeur concernera les adolescents et les hommes. L’Agence européenne du médicament (EMA) a fait part en 2023 d’une étude menée sur la base de données de santé de nombreux patients dans plusieurs pays scandinaves et concluants à un risque « modéré » de troubles du développement chez les enfants de pères traités sous valproate, une molécule qui agit aussi sur la qualité du sperme.
« Il n’y a pas eu de nouvelles données, mais compte tenu du risque potentiel et d’un renforcement de l’information demandé par l’Union européenne, nous avons jugé nécessaire de compléter le dispositif », a justifié Philippe Vella. L’agence française « va plus loin que préconisé par l’UE et a pris le temps nécessaire aux échanges avec les soignants, associations de patients et laboratoires pour trouver un équilibre entre les besoins et aspirations de tous », a-t-il ajouté.
À partir du 6 janvier, seuls des neurologues, psychiatres et pédiatres pourront initier les traitements au valproate -le renouvellement pourra être prescrit par tout médecin. Les patients déjà sous traitement devront prendre rendez-vous d’ici au 30 juin avec leur spécialiste. Environ 160.000 hommes de 15 à 69 ans sont traités en France par du valproate, selon l’ANSM. Une attestation d’information partagée, notamment sur les risques encourus, devra aussi être cosignée chaque année par le patient et le prescripteur, et présentée en pharmacie, en plus de l’ordonnance, pour obtenir le médicament. Pour les filles, adolescentes et femmes, cette attestation remplacera l’actuel formulaire d’accord de soins.
« Trop de grossesses exposées »
Pour la carbamazépine, l’information des filles, adolescentes et femmes susceptibles d’avoir des enfants ou enceintes sera renforcée, via une attestation similaire. Si « les risques de malformations et troubles du neurodéveloppement liés à l’exposition maternelle à ce médicament sont connus de longue date », a noté Philippe Vella, « il y a encore trop de grossesses exposées alors qu’il y a des situations où l’utilisation devrait être évitée ».
Environ 20.000 femmes en âge de procréer sont traitées en France à la carbamazépine. L’ANSM a demandé aux fabricants des médicaments à base de valproate et carbamazépine de mettre des messages temporaires sur les boîtes pour prévenir des nouvelles modalités de prescription en 2025 et inviter à consulter. Pour les médicaments à base de topiramate, le changement est un peu différent.
Pour des femmes souffrant de migraine, les médecins compétents « douleur » pourront, en plus des neurologues, prescrire ce traitement à partir du 6 janvier. Par ailleurs, une attestation d’information partagée deviendra aussi nécessaire pour se faire délivrer du Topiramate. Ces annonces interviennent dans un contexte où l’ANSM durcit depuis plusieurs années sa politique envers des anti-épileptiques jugés à risque pendant la grossesse.
La Dépakine est en France au cœur de nombreuses procédures judiciaires, encore en cours, mais ayant déjà donné lieu à plusieurs décisions défavorables au fabricant, Sanofi. Mais chez certains patients, seuls ces traitements se révèlent efficaces. Aux médecins donc d’évaluer si les risques des crises et autres troubles sont suffisamment élevés pour compenser ceux du traitement.